蒸汽性质
通过了解物质的一般分子和原子结构,并将此知识应用于冰,水和蒸汽,可以更好地了解蒸汽的性质。
分子是仍具有可以存在的所有化学性质的任何元素或复合物质中的最小量。分子本身由甚至称为原子的较小颗粒组成,这些颗粒定义了氢和氧等基本元素。
这些原子元素的特定组合提供了复合物质。一种这样的化合物由化学式H 2 O表示,具有由两个氢原子和一个氧原子组成的分子。
水在地球上如此丰富的原因是因为氢和氧是宇宙中最丰富的元素之一。碳是大量丰富的另一种元素,并且是所有有机物中的关键成分。
大多数矿物物质可以三种物理状态(固态,液态和蒸气)存在,这三种状态称为相。在H 2 O 的情况下,术语冰,水和蒸汽分别用于表示三相。
冰,水和蒸汽的分子排列仍未完全了解,但考虑分子通过电荷(称为氢键)结合在一起很方便。
分子的激发程度决定了物质的物理状态(或相)。
三重点
特定物质的所有三相只能在一定温度和压力下平衡共存,这被称为三相点。
H 2 O 的三相点(冰,水和蒸汽的三相处于平衡状态)出现在273.16 K的温度和0.006 112 bar的绝对压力下。该压力非常接近理想真空。如果在此温度下压力进一步降低,则冰会融化而不是直接升华成蒸汽,而不是融化。
冰
在冰中,分子以有序的点阵型结构锁定在一起,并且只能振动。在固相中,分子在晶格中的运动是围绕平均键合位置的振动,在该位置上,分子的间距小于一个分子的直径。
持续增加的热量使振动增加到一定程度,以至于某些分子最终会脱离其邻居,并且固体开始融化为液态。在大气压下,熔化在0°C发生。压力变化对熔融温度的影响很小,对于大多数实际目的,可以将0℃作为熔点。但是,已经表明,每增加一个压力大气压,冰的熔点下降0.0072℃。例如,需要13.9 bar g的压力才能将熔融温度降低0.1°C。
破坏晶格键以产生相变而又不增加冰的温度的热称为熔化焓或熔化热。当发生冻结且将等量的热量释放回周围环境时,这种相变现象是可逆的。
对于大多数物质,密度会从固相变为液相时降低。但是,H 2 O是该规则的一个例外,因为其密度会随着融化而增加,这就是为什么冰漂浮在水上的原因。
水
在液相中,分子可以自由移动,但由于相互吸引,彼此之间的距离仍然小于一个分子直径,并且经常发生碰撞。更多的热量会增加分子搅动和碰撞,从而将液体的温度提高到沸腾温度。
的水,液体焓或显热(H焓˚F)的水
这是将水的温度从0°C基准点升高到当前温度所需的热能。
在0°C的参考状态下,水的焓已任意设置为零。然后,相对于此易于访问的参考状态,可以确定所有其他状态的焓。
显热曾经是一个术语,因为添加到水中的热量会引起温度变化。但是,这些天接受的术语是液体焓或水焓。
在大气压(0 bar g)下,水在100°C沸腾,需要419 kJ的能量才能将1 kg的水从0°C加热到其沸腾温度为100°C。从这些图中可以得出,在0°C至100°C之间的大多数计算中,水的比热容(C p)值为4.19 kJ / kg°C。
蒸汽
随着温度的升高和水接近沸腾状态,一些分子获得足够的动能以达到一定的速度,从而使它们可以暂时从液体中逃逸到表面上方的空间中,然后再回到液体中。
进一步加热会引起更大的激发,并且具有足够能量离开液体的分子数量会增加。当水被加热到沸点时,蒸汽气泡在其中形成并上升以穿透表面。
考虑到液体和蒸气的分子排列,逻辑上蒸汽的密度要比水的密度小得多,这是合乎逻辑的,因为蒸汽分子之间的距离更远。因此,紧邻水面的空间充满了密度较小的蒸汽分子。
当离开液体表面的分子数量多于重新进入的分子数量时,水会自由蒸发。在这一点上它已经达到沸点或其饱和温度,因为它被热能所饱和。
如果压力保持恒定,则增加热量不会使温度进一步升高,而会使水形成饱和蒸汽。同一系统中沸水和饱和蒸汽的温度相同,但是蒸汽中每单位质量的热能要大得多。
在大气压下,饱和温度为100°C。但是,如果压力增加,这将允许增加更多的热量并增加温度,而不会发生相变。
因此,增加压力有效地增加了水的焓和饱和温度。饱和温度和压力之间的关系称为蒸汽饱和曲线(见下图)。
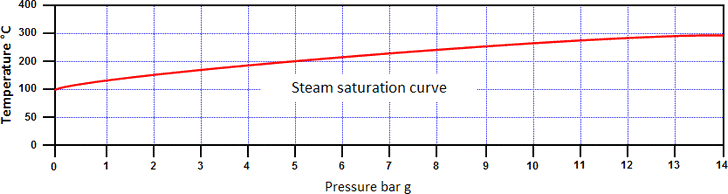
水和蒸汽可以在此曲线上的任何压力下共存,都处于饱和温度。在高于饱和曲线的条件下的蒸汽称为过热蒸汽:
高于饱和温度的温度称为蒸汽过热度。
曲线下方条件下的水称为过饱和水。
如果蒸汽能够以与其产生的速率相同的速度从锅炉中流出,则进一步增加热量只会增加生产率。如果限制蒸汽离开锅炉,并且保持热量输入速率,则流入锅炉的能量将大于流出的能量。由于饱和蒸汽的温度与其压力相关,因此多余的能量会升高压力,进而使饱和温度升高。
蒸发焓或潜热(H fg)
这是在沸腾温度下将水的状态改变为蒸汽所需的热量。它不涉及蒸汽/水混合物温度的变化,并且所有能量都用于将状态从液体(水)更改为蒸汽(饱和蒸汽)。
过去的潜热是基于这样的事实,尽管添加了热量,但温度没有变化。但是,现在公认的术语是蒸发焓。
就像从冰到水的相变一样,蒸发过程也是可逆的。当蒸汽在较低温度下遇到任何表面时,在冷凝过程中产生蒸汽的热量会释放回周围的环境。
这可以被认为是用于加热目的的蒸汽中有用的热量,因为当蒸汽凝结成水时,就是蒸汽中总热量的一部分。
饱和蒸汽的焓或饱和蒸汽的总热量
这是饱和蒸汽的总能量,仅是水的焓和蒸发的焓之和。
H g = H f + H fg
H g =饱和蒸汽的总焓(总热量)(kJ / kg)
H f =液体焓(显热)(kJ / kg)
H fg =蒸发焓(潜热)(kJ / kg)
饱和蒸汽表
蒸汽表列出了不同压力下蒸汽的性质。它们是在蒸汽上进行的实际测试的结果。下表显示了在大气压-0 barg至5 barg下的干燥饱和蒸汽的性质。
| 按下 barg | 卫星- uration 温度℃下 | 焓(能量),千焦/千克 | 干 饱和蒸汽量m3 / kg | ||
| 水h f | Eva- 穿孔^ h FG | 蒸汽ħ 克 | |||
| 0 | 100 | 419 | 2257 | 2676 | 1.673 |
| 1个 | 120 | 506 | 2201 | 2707 | 0.881 |
| 2 | 134 | 562 | 2163 | 2725 | 0.603 |
| 3 | 144 | 605 | 2133 | 2738 | 0.461 |
| 4 | 152 | 641 | 2108 | 2749 | 0.374 |
| 5 | 159 | 671 | 2086 | 2757 | 0.315 |
干燥分数
温度等于该压力下的沸点的蒸汽称为干饱和蒸汽。但是,在设计用于产生饱和蒸汽的工业锅炉中生产100%干蒸汽的可能性很小,并且蒸汽通常会包含水滴。
在实践中,由于湍流和飞溅,当蒸汽气泡冲破水面时,蒸汽空间包含水滴和蒸汽的混合物。
在仅将热量提供给水并且蒸汽保持与水表面接触的任何壳式锅炉中产生的蒸汽通常可包含约5质量%的水。
如果蒸汽的水含量为5质量%,则蒸汽被称为95%干燥并且具有0.95的干燥分数。
湿蒸汽蒸发的实际焓是蒸汽表中干燥分数(X)和比焓(H fg)的乘积。湿蒸汽将比干饱和蒸汽具有更低的可用热能。
实际蒸发焓= H fg X
因此:
实际总焓= H f + H fg X
由于水的特定容积比蒸汽的容积低几个数量级,因此湿蒸汽中的水滴将占据可忽略的空间。因此,湿蒸汽的比体积将小于干蒸汽:
实际比容= V g X
其中V g是干燥饱和蒸汽的比容。
蒸汽相图
蒸汽表中提供的数据也可以图形形式表示。下面的图像说明了水和蒸汽的各种状态的焓和温度之间的关系;这被称为相图。
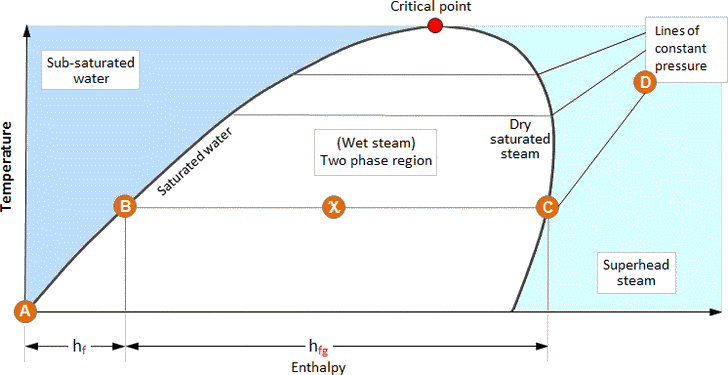
当水从0°C加热到其饱和温度时,其状态遵循饱和水线,直到它收到所有的液体焓H f(A - B)。
如果继续增加热量,水会变成水/蒸气混合物,并继续增加焓,同时保持在饱和温度H fg(B - C)。
随着水/蒸气混合物的干燥度增加,其条件从饱和液体管线移至饱和蒸气管线。因此,在这两种状态之间恰好中间的一点上,干燥分数(X)为0.5。同样,在饱和蒸汽管线上,蒸汽是100%干燥的。
一旦接收到所有的蒸发焓,它便到达饱和蒸汽管线。如果在此之后继续加热,压力将保持恒定,但是随着过热的产生,蒸汽的温度将开始升高(C - D)。
饱和水和饱和蒸汽管线围绕着一个存在水/蒸汽混合物的区域-湿蒸汽。在饱和水管线左侧的区域中仅存在水,而在饱和蒸汽管线右侧的区域中仅存在过热蒸汽。
饱和水和饱和蒸汽管线相遇的点称为临界点。随着压力增加到临界点,蒸发焓降低,直到在临界点变为零为止。这表明水在临界点直接变成饱和蒸汽。
高于临界点,蒸汽可被视为气体。气态是最扩散的状态,其中分子具有几乎不受限制的运动,并且随着压力的降低,体积无限制地增加。
临界点是可以存在水的最高温度。高于临界点的恒定温度下的任何压缩都不会产生相变。
但是,在低于临界点的恒定温度下压缩会导致蒸汽从过热区域进入湿蒸汽区域时液化。
临界点出现在374.15°C和221.2 bar a的蒸汽下。高于此压力,蒸汽被称为超临界蒸汽,没有明确定义的沸点适用。
闪蒸蒸汽
传统上,术语“闪蒸蒸汽”用于描述从冷凝水接收器排气孔和来自疏水阀的开放式冷凝水排放管线发出的蒸汽。在不增加热量的情况下如何由水形成蒸汽?
只要高压水(且温度高于低压液体的饱和温度)下降到较低压力,就会发生闪蒸蒸汽。相反,如果高压水的温度低于低压下的饱和温度,则不能形成闪蒸蒸汽。在冷凝水通过疏水阀的情况下,通常上游温度足够高以形成闪蒸蒸汽。见下图
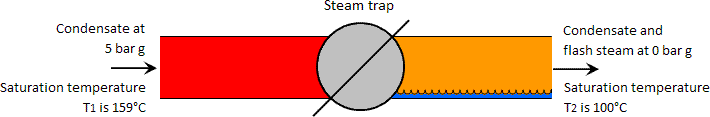
考虑一千克冷凝水,压力为5 bar g,饱和温度为159°C,该蒸汽通过疏水阀达到0 bar g的较低压力。在5 bar g的饱和温度下,一千克冷凝物中的能量为671 kJ。根据热力学第一定律,疏水阀疏水侧流体中所含的能量必须等于高压侧流体中的能量,并构成能量守恒的原理。
因此,一千克低压流体中包含的热量也为671 kJ。但是,0 bar g的水只能包含419 kJ的热量,随后在低压侧671-419 = 252 kJ的热量似乎不平衡,就水而言,这可能是被认为是多余的热量。
多余的热量使一些冷凝水沸腾成所谓的闪蒸蒸汽,沸腾过程称为闪蒸。因此,在蒸汽疏水阀的高压侧以一千克液态水存在的一千克冷凝水现在在低压侧以水和蒸汽的形式部分存在。
在最终压力(产生的闪蒸蒸汽的量P 2:可以使用所确定的)
的闪蒸蒸汽的比例=(Ħ ˚F在P 1 - (+)Ħ ˚F在P 2)/ Ħ FG在P 2
P 1 =初始压力
P 2 =最终压力
H f =液体焓(kJ / kg)
H fg =蒸发焓(kJ / kg)
示例:高压冷凝液温度高于低压饱和温度的情况。
考虑压力为5 bar g的水,其饱和温度为159°C时包含671 kJ / kg的热能。如果然后将压力降低到大气压(0 bar g),则水只能在100°C存在,并且包含419 kJ / kg的热能。671-419 = 252 kJ / kg的热能差将在大气压下产生闪蒸蒸汽。
670.9 - 419.0
2257.0
670.9-419.0
0.11千克蒸汽/千克水
产生的闪蒸蒸汽的比例可以认为是过量能量与最终压力下蒸发焓的比值。
示例:高压冷凝水温度低于低压饱和温度的情况。
温度为90°C,即过冷至大气饱和温度100°C以下。注意:冷凝水温度从其饱和温度大幅下降(在这种情况下为159°C至90°C)通常不可行;它只是用来说明在这种情况下不会产生闪蒸蒸汽的观点。
在这种情况下,亚饱和水位表显示,在5 barg和90°C下,一千克冷凝水的液体焓为377 kJ。由于该焓小于大气压下(419 kJ)的一千克饱和水的焓,因此没有多余的热量可用于产生闪蒸蒸汽。冷凝物仅通过捕集阱,并在相同温度下保持液态,但在这种情况下压力较低,即大气压。参见下图。
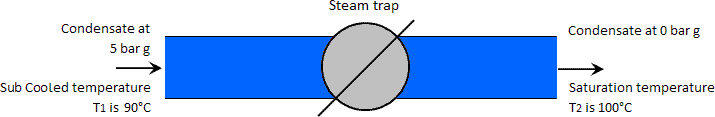
90°C时水的蒸汽压为0.7 bar绝对压力。如果较低的冷凝水压力小于此压力,则将产生闪蒸蒸汽。
两种过程状态之间能量和质量守恒的原理。
能量和质量守恒的原理使得可以从不同的方向来考虑闪蒸现象。
1 kg冷凝水在159°C和5 bar g下在大气压下产生0.112 kg闪蒸蒸汽。可以在下表中示意性地说明。闪蒸和冷凝水的总质量保持在1 kg。



